24-7

OptiMate’s 24-7 battery maintenance program found in every OptiMate battery charger is designed to prolong the life and maximise the strength of a stored battery. The battery can be safely left connected for months or years as the program adjusts according to the battery’s needs, periodically delivering just the right amount to keep the battery optimally charged, but never overcharging.

The need for battery maintenance depends on two variables – 1) Battery type – Lead-acid & Lithium-Ion batteries differ in how they generate electricity and therefore need different maintenance charging when stored. 2) How fast charge is lost through self-discharge and parisitic draw.
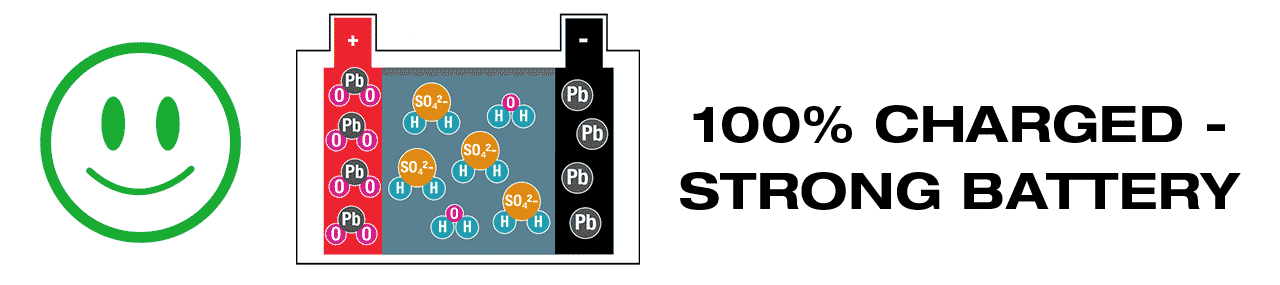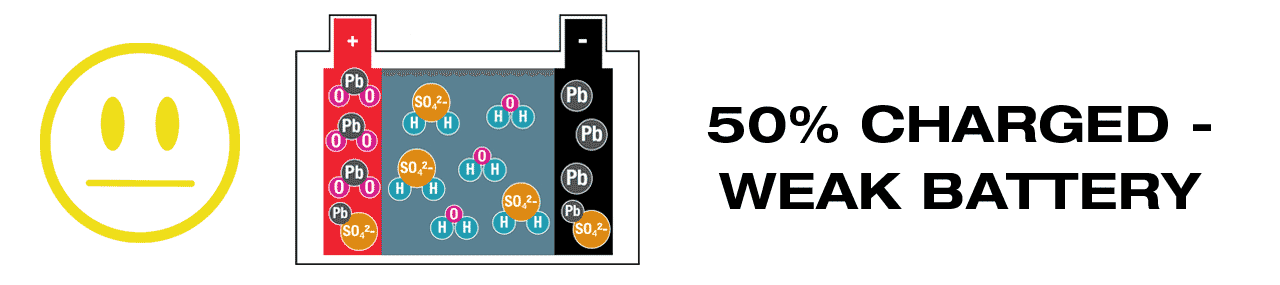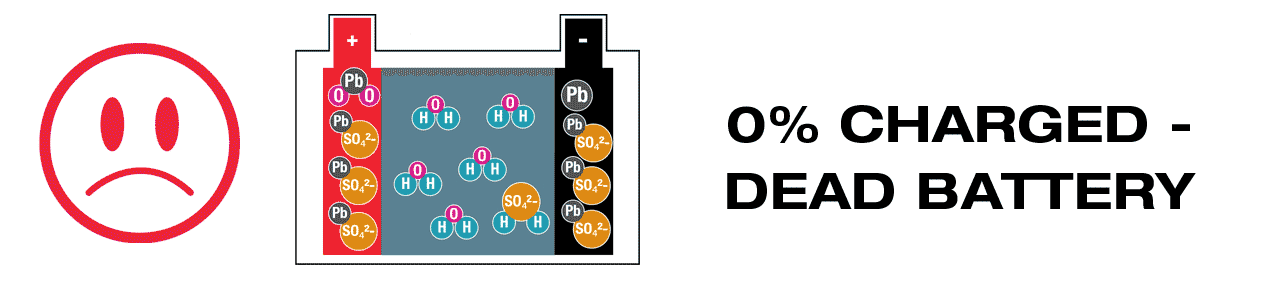
A lead-acid battery actively generates electricity; different chemicals within react to each other and fuse together, in the process creating ‘waste’ chemicals that must be recycled during charging, with lead-sulphate (PbSO4) the most critical. It is essential that lead-sulphate is recycled soon after discharge (link: WHY?). In fully charged lead-acid battery there should be no lead-sulphate present.
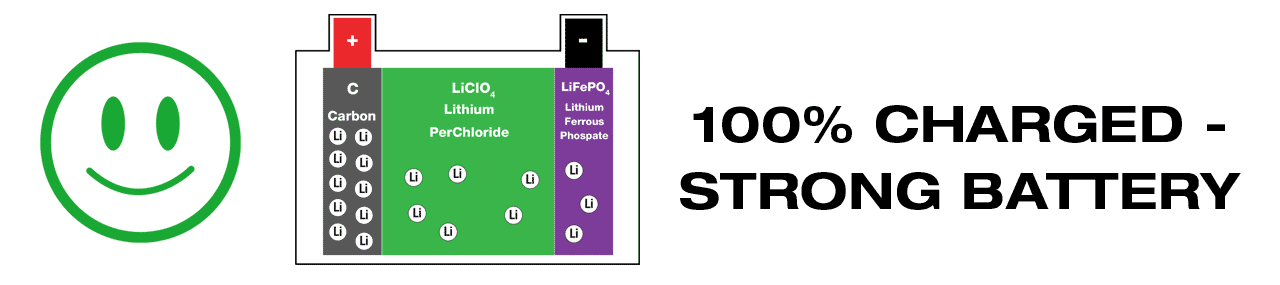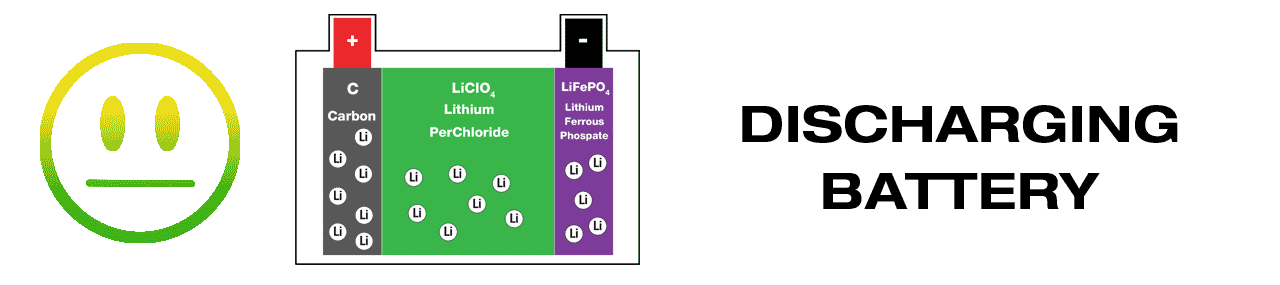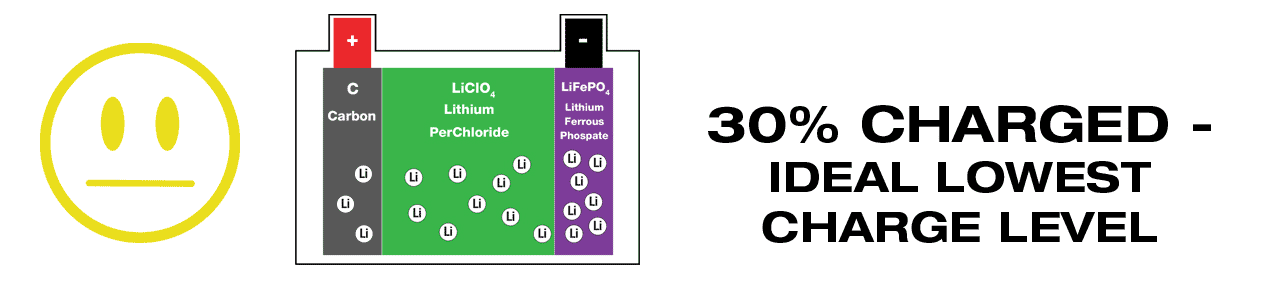
A Lithium battery passively generates electricity; Li-Ions flow from the anode (-) to the cathode (+) of a cell and that causes static electricity. When receiving charge the Li-ion flow is reversed, Li-Ions are returned to the anode. It is essential that a balance is maintained and there are sufficient Li-Ions at the anode and cathode after discharge or recharge. (link: WHY?).
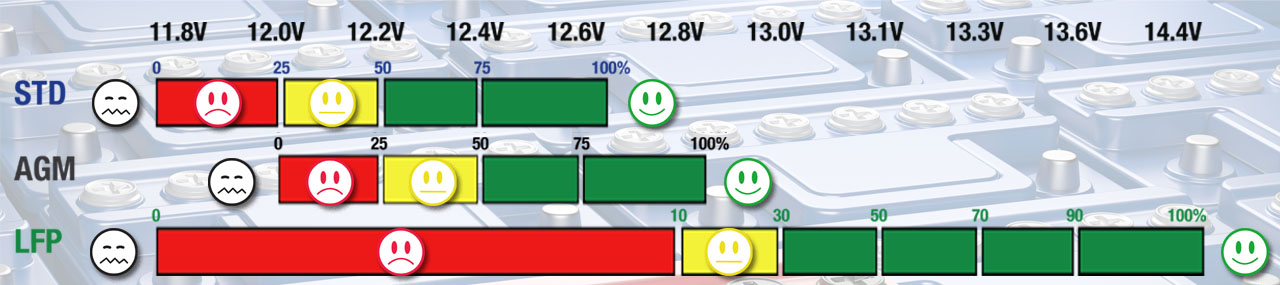
Deep discharge below the battery’s safe voltage level weakens any battery. Even if recovered, the battery is not as strong as it used to be, subsequently the battery works harder which causes more stress, resulting in a shortened lifespan.

All batteries self-discharge when stored, even if not connected to electrical circuitry, using their own stored energy to maintain their voltage. A lead-acid battery discharges at 4% per month where-as a Lithium battery discharges at 1% per month.

Parasitic current draw from connected circuitry (such as ‘always on’ electronics in a stored vehicle) add to the battery’s self-discharge current; the battery discharges faster. The storage capacity (in Ah) of the battery determines how long the battery remains within its safe operating range, a smaller battery with a lower Ah rating will reach its minimum safe voltage level quicker. As an example, a typical 10 milli-amp draw from connected circuitry causes loss of 1.7 Ah every 7 days.

Lead-acid batteries require maintenance charging more frequently, to ensure that all ‘waste’ chemicals created during charging, are promptly and completely recycled. The most urgent is the ‘waste’ chemical lead-sulphate (PbSO4), it will crystallize if left dormant for too long, even when the battery voltage still appears to be sufficient. (Learn more here – Pb). OptiMate’s 24-7 maintenance program checks charge level hourly and delivers sufficient charge to keep the battery at 100%, with a continuous ‘desulphation’ pulse breaking up any remaining crystallized lead-sulphate. A lead-acid battery kept at full charge remains strong for longer.

Lithium batteries have the easiest maintenance routine, the battery remains healthy if kept above its minimum recommended voltage / State Of Charge. It might only need charge occasionally.
OptiMate 24-7 battery maintenance program checks charge level hourly and will deliver charge when necessary, keeping the battery within a 70-90% state of charge. A Lithium battery kept at the right charge remains strong for longer.
FAQ
Dans une batterie au plomb-acide, les principaux composants chimiques sont les plaques de cathode en plomb (Pb), les plaques d’anode en oxyde de plomb (PbO2) et l’électrolyte qui est de l’acide sulfurique dilué (H2SO4).
Lorsque l’énergie de la batterie est utilisée, le soufre (SO4) de l’électrolyte s’associe avec le plomb à la surface des plaques pour créer du sulfate de plomb (PbSO4). Une batterie au plomb-acide est complètement déchargée lorsque l’électrolyte ne contient plus de soufre du tout (SO4), pour laisser place la plupart du temps à de l’eau (H2O). Lors de sa recharge, les atomes de sulfate de plomb sont détruits, le plomb (Pb) reste sur les plaques et le soufre (SO4) est réabsorbé dans l’électrolyte, créant de nouveau de l’acide sulfurique (H2SO4). Une batterie au plomb-acide est complètement chargée lorsqu’il ne reste plus de sulfate de plomb (PbSO4).
Dans une batterie active, la présence de sulfate de plomb ne présente aucun danger car il est continuellement créé et désagrégé. Lorsque la batterie est laissée trop longtemps dans un état de décharge partielle, le sulfate de plomb non converti (Pb-SO4) se cristallise et durcit à la surface des plaques, ce qui rend plus difficile sa désagrégation lorsque la batterie est à nouveau chargée. La zone de surface réduite par le plomb a une incidence sur la capacité de la batterie à fournir et à maintenir une alimentation, c’est-à-dire que la capacité de la batterie est moindre (capacité en Ah moins importante) et est par conséquent plus faible. Le fait de maintenir une batterie au plomb-acide à pleine charge permettra d’éviter une perte de puissance. Vous pouvez également la recharger régulièrement, idéalement avant que la batterie ne tombe en dessous de 75% de son état de charge.
L’électrolyte de la batterie est de l’acide sulfurique dilué (H2SO4 + H2O).
Dans une batterie chargée, la concentration d’acide sulfurique (H2SO4) est supérieure à celle de l’eau (H2O), ce qui réduit le point de congélation de l’électrolyte à -95°F/ -71°C. Lorsque la batterie se décharge, la concentration d’acide sulfurique diminue et la teneur en eau augmente. Le point de congélation de l’électrolyte se rapproche alors de celui de l’eau. Une batterie avec un niveau de charge de 50 % possède un point de congélation d’environ -22°F/-30°C. En revanche, l’électrolyte d’une batterie complètement déchargée n’est composée quasiment que d’eau (H2O) avec un point de congélation de 32°F/0°C. Lorsque l’eau gèle, elle se dilate de 120% ce qui endommage la batterie de l’intérieur. Le fait de maintenir une batterie au plomb-acide à pleine charge permettra d’éviter que la batterie ne gèle, même par grand froid.
Un surplus de sulfate de plomb à l’intérieur de la batterie empêche le flux d’électricité à des tensions de charge normales (par exemple 14.4V pour une batterie de 12V) - la batterie est incapable de maintenir une charge. Pour récupérer la batterie, une tension plus élevée est nécessaire afin de surmonter la résistance causée par des taux de sulfate de plomb trop élevés et permettre la circulation de l’électricité. Les chargeurs OptiMate de récupération de batterie au plomb-acide peuvent récupérer des batteries totalement à plat dont la tension atteint même 0.5V.
Une fois que l’intégralité du sulfate de plomb a été convertie, le flux d’électricité continu augmente la température de l’électrolyte et émet de l’hydrogène et de l’oxygène. L’électrolyte pourra éventuellement "se dessécher", la batterie exigera alors davantage de courant de charge, ce qui détruira alors ses plaques. Lorsqu’ils sont emprisonnés, l’hydrogène et l’oxygène peuvent entraîner une explosion.
Chaque cellule d’une batterie LFP Lithium comprend trois principaux composants, la cathode en phosphate ferreux de lithium (LFP - LiFePo4), l’anode en carbone (C) et l’électrolyte à base de lithium (LiCIO4 - perchlorure de lithium) qui transfère l’énergie entre les cellules.
Les batteries au lithium créent de l’électricité en faisant se déplacer les ions de lithium (Li-Ions) entre la cathode et l’anode par le biais de l’électrolyte. Aucun déchet chimique supplémentaire n’est créé. Lorsqu’ils sont déchargés (la batterie fournissant de l’énergie), les ions de lithium se déplacent de l’anode vers la cathode. Une fois rechargés, les ions de lithium se déplacent dans le sens inverse, de la cathode vers l’anode. Une batterie au lithium reste en bon état s’il y a toujours suffisamment d’ions de lithium au niveau de la cathode, de l’anode et dans l’électrolyte, c’est-à-dire que la batterie n’est jamais trop faiblement déchargée et trop fortement chargée.
Tous les ions de lithium sont concentrés sur la cathode avec une toute petite quantité sur l’anode. Cela a pour conséquence de compromettre la structure de l’anode en carbone qui ne peut pas recevoir d’ions de lithium à un niveau de charge normale. Dans le cas d’une recharge trop rapide, ou même de l’utilisation de câbles de démarrage, les ions de lithium bombardent l’anode en carbone et provoquent sa surchauffe. Une charge contrôlée très lente à faible courant est nécessaire pour récupérer la batterie afin de permettre à l’anode d’absorber lentement les ions de lithium jusqu’à ce qu’elle puisse à nouveau recevoir une charge normalement. Les chargeurs OptiMate Lithium pour les batteries LFP Lithium peuvent récupérer des batteries totalement à plat dont la tension atteint même 0.5V.
Une fois la charge complète atteinte, l’anode en carbone de chaque cellule est entièrement chargée d’ions de lithium et ne peut plus en recevoir. Mais à cause du flux d’électricité continu, les ions de lithium tentent de pénétrer dans l’anode, ce qui provoque une surchauffe du carbone. Une fois la température critique atteinte, une combustion spontanée se produit et la batterie peut prendre feu.